Inhaltsverzeichnis
Bleibatterien Basis Wissen
Blei-Batterien sie sind aktuell die preiswerteste Möglichkeit für Privatpersonen elektrische Energie zu speichern, insbesondere wenn große Reserven benötigt werden. Generell entfällt ein sehr großer Anteil der Kosten einer Inselanlage auf den Speicher. Es rentiert sich also, sich ein paar Gedanken über die Batterien zu machen und wie man mit teilweise einfachen Methoden ihre Lebensdauer beträchtlich steigern kann.
Dieser Batterietyp ist über 150 Jahre alt, wird seit knapp über 100 Jahren auch industriell eingesetzt und in Automobilen werden diese Batterien millionenfach verbaut. Daher sollte man eigentlich vermuten, dass die Abläufe, die sich in so einer Batterie abspielen, auf breiter Ebene bekannt sind. Das ist leider nicht der Fall, weshalb wir mit den absoluten Grundlagen beginnen.
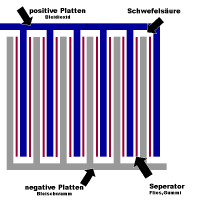
Grundsätzlicher Aufbau einer Batterie
Positive Platte
Die positive Platte besteht aus Bleidioxid PbO2, das um ein Gitter, meist aus Hartblei, herumgepresst ist. Hartblei ist Blei dem wenige Prozent Antimon (Sb) zulegiert sind. Daurch wird das Gitter stabiler, was vor allem Akkus in Fahrzeugen zu längerem Leben verhilft.
Negative Platte
Besteht aus hochporösem Schwammblei um ein Bleigitter herum.
Speratoren
Damit kein Kurzschluss zwischen positiver und negativer Platte entsteht, werden als Trennung zwischen den Platten Seperatoren aus Glasfasern oder säurefestem Kunststoffgitter eingelegt.
Elektrolyt
Der Elektrolyt, gemeinhin als Batteriesäure bezeichnet, ist mit reinem Wasser auf etwa 20 Gewichtsprozent verdünnte Schwefelsäure <chem>H2SO4</chem>.
Chemische Vorgänge
Beim Entladen:
Positive Platte: <chem>PbO2 + H2SO4 + 2 H+
+ 2 e-
⇒ PbSO4 + 2 H2O</chem>
Negative Platte :<chem> Pb + SO4
2- - 2 e-
⇒ PbSO4
</chem>
Hier werden also Elektronen von der negativen zur positiven Platte geleitet. Der Strom fließt mit der Spannung.
Die Schwefelsäure wird dabei in den Platten gebunden. Die Dichte des Elektrolyten nimmt ab.
Beim Laden laufen die Reaktionen in Gegenrichtung ab:
Positive Platte: <chem>PbSO4 + 2 H2O - 2 e-⇒ PbO2 + H2SO4 + 2 H+
</chem>
Negative Platte: <chem>PbSO4 + 2 e-
⇒ Pb + SO4
2-
</chem>\\
Hier werden also Elektronen von der positiven Platte abgezogen und der negativen Platte gegen die Spannung zugeführt.
Die Schwefelsäure geht in den Elektrolyten. Die Säuredichte nimmt zu.
Details zu den chemischen Vorgängen in: Die Chemie der Blei-Säure-Batterie Details
Physikalische Vorgänge
Die postiven wie auch negativen Elektroden sind porös, damit die Batteriesäure eindringen und eine möglichst große innere Oberfläche benetzen kann. Die elektrochemischen Umwandlungen beim Laden und Entladen finden nur durch den Elektrolyten an der inneren Oberfläche dieser Poren- und Kanalstruktur statt. Dabei ändert sich Konzentration der Säure zunächst in den Poren. Durch Diffusion nähern sich die Konzentrationen der Säure in den Poren und zwischen den Platten einander langsam an. Die Diffusion und damit der Ausgleich der Konzetrationen läuft immer nur mit begrenzter Geschwindigkeit ab. Je schneller ge- bzw. entladen wird, um so stärker werden die Konzentrationsunterschiede und umso schneller die Diffusion. Weil die Diffusion aber immer langsamer ist als der Stromfluss, nähert sich die Spannung nach Lade- bzw. Entladeende anfangs schneller, dann immer langsamer einem Wert an, der sich dann weiter durch die Selbstentladung erniedrigt. Je schneller entladen wird, umso weniger können die elektrochemischen Umwandlungen auch noch in den hintersten Winkeln und feinsten Poren ablaufen. Deshalb scheint die Kapazität der Batterie bei schneller Entladung geringer zu sein.
Kapazitätsverlust
Durch Batteriealterung oder fehlerhafte Behandlung wird die Porenstruktur der Elektroden gestört. Bleisulfatkristalle verstopfen Poren und Kanäle der Elektroden zunehmend. Dieser als Sulfatierung bezeichnete Vorgang hat zur Folge, dass die Diffussion immer schlechter vonstatten geht und die Kapazität der Batterie immer weiter sinkt, bis schlußendlich die meisten Kanäle von Bleisulfat verschlossen sind, was gleichbedeutenden ist mit weitgehendem Kapazitätsverlust.
Säureschichtung
 Als Säureschichtung bezeichnet man das bilden unterschiedlicher Säurekonzentrationen innerhalb einer Bleibatteriezelle.
Als Säureschichtung bezeichnet man das bilden unterschiedlicher Säurekonzentrationen innerhalb einer Bleibatteriezelle.
Wie passiert das
Die Schichtung entsteht selbständig durch chemische und physikalische Prozesse beim Laden der Batterie: Beim Laden wird, wie oben erklärt, aus den Elektroden Schwefelsäure an den Elektrolyten abgegeben. Die Schwefelsäure ist schwerer als der Elektrolyt. Folglich sinkt die Schwefelsäure nach unten und bildet dort eine Schicht höherer Konzentration.
Auswirkungen
beim Entladen
Der Strom fließt dort am besten durch den Elektrolyten, wo die Schwefelsäurekonzentration am höchsten ist. Dort bildet sich auch zuerst das Bleisulfat in den Elektroden und bleibt dort auch beim Laden länger. Die Sulfatierung nimmt auch mit zunehmender Schwefelsäurekonzentration zu und damit der Kapazitätsverlust bzw. die Alterung.
beim Laden
Der Prozess läuft dem beim Entladen genau entgegengesetzt. Im oberen Bereich fehlt die beim Entladen abgesunkene Schwefelsäure. Deshalb wird die Kapazität der Elektroden im oberen Bereich nicht ausgenutzt. Der Ladestrom bildet mehr und mehr Knallgas. Im unteren Bereich ist zuviel Säure. Sie bleibt ungenutzt übrig, wenn die Ladung beendet wird.
Im Ruhezustand
Die chemischen Prozesse in einer Batterie laufen langsam weiter, das bedeutet Selbstentladung. Da Schwefelsäure höherer Konzentration schwerer ist als weniger konzentrierte, bleibt die beim Laden entstandene Schichtung auch ohne Ladung bzw Entladung lange bestehen. In Folge führt das zu schnellerer Sulfatierung des unteren Bereichs der Elektroden.
Säureschichtung bei Gel- und AGM-Batterien
Bei einer Gel-Batterie wird die Säure zu einer puddingartigen Masse geformt. Die Säure kann nicht mehr frei fließen sondern nur noch viel langsamer diffundieren. Vollständig fixiert ist sie hingegen nicht, denn sonst könnte die Batterie nicht funktionieren. Bis sich hier eine ausgeprägte Säureschichtung ausbildet, ist die Batterie schon an ihr natürliches Lebensende gekommen.
Bei AGM-Batterien werden die Elektroden mit Hilfe einer Glasfasermatte von einander getrennt und diese Matte ist mit Säure durchtränkt (oftmals werden die Elektroden zusammen mit den Matten stramm aufgewickelt; daher haben diese Batterien eine recht kompakte Bauform und sind extrem rüttel- und schüttelfest). Die Säure ist in der Glasfasermatte weniger beweglich. In einer AGM-Batterie kann sich also durchaus eine starke Säureschichtung aufbauen, wenn auch viel langsamer als in der Batterie ohne Glasfaser oder Gel. Allerdings gibt es überhaupt keine Möglichkeit, sie wieder abzubauen.
BatterieGasung / Gasungsspanung
Batterien dieser drei Typen haben in der Ausführung als PzS oder OPzS bei 100 Ah und 12 Volt Nennspannung einen Innenwiderstand von etwa 6 Milliohm. Wenn man diese Batterien mit einem I5 von 20 Ampere lädt, dann werden am Innenwiderstand 2,4 Watt in Wärme umgesetzt; da bräuchte man schon sehr gute Messtechnik, um diese Erwärmung nachweisen zu können.
Eine Blei-Säure-Batterie gast, wenn die Ladespannung zu hoch ist. Dann entweicht die Energie, die in die Elektrolyse gesteckt wird, als potentielle Bindungsenergie zusammen mit den Gasen. Eine Blei-Säure-Batterie wird also auch bei Ladung mit einem erhöhten Strom nicht warm und das Gasen ändert hieran nichts, es wird nur mehr Gas. Merkliches Gasen setzt je nach Bleizusammensetzung bei 2,3 bis 2,4 V Ladespannung je Zelle ein.
Gel- und AGM-Batterien dürfen nicht stark gasen, denn sie haben ein versiegeltes Gehäuse; es kann also kein Gas entweichen ( Es gibt ein Sicherheitsventil, das bei starkem Überdruck öffnet, damit das Gas das Gehäuse nicht zerreißt. Gas, das entweicht, fehlt später in Form von Wasser und die Zelle trocknet aus). Es lässt sich nicht vollkommen verhindern, dass eine elektrolytische Zersetzung von Wasser stattfindet, jedoch wird dafür gesorgt, dass die Gase zu einem großen Teil rekombinieren und wieder Wasser bilden. Die Energie, die in die Elektrolyse gesteckt wurde, wird also in Form von Wärme wieder frei. Diese Batterien können sich also bei zu hohen Ladespannungen erheblich aufheizen.
Wenn man nicht sicher verhindern kann, dass es bei diesen Batterietypen ( Gel und AGM ) zu stärkerer Gasung kommen könnte, dann sollte man eine Temperaturüberwachung nachrüsten, die den Ladestrom reduziert oder gar den Ladevorgang so lange unterbricht, bis die Batterie wieder eine akzeptable Temperatur hat.
Entladetiefe / Zyklenangaben
Es gibt 2 Möglichkeiten, um die Entladetiefe einer Batterie anzugeben.
**DOD** (Depth Of Discharge)
Bezeichnet den Entladezustand einer Batterie. DOD 0 seht für 0% entladen(voll), DOD 100 würde für 100% entladen (leer) stehen. Oft wird es im Zusammenhang mit Zyklen verwendet. z.B. Angaben 200 Zyklen mit DOD 100. Dies würde bedeuten das eine Batterie 200mal zu 100% entladen werden kann, bevor diese als für den industriellen Einsatz nicht mehr geeignet anzusehen ist; im privaten Bereich kann man diese Batterie natürlich noch lange weiter nutzen.
**SOC** (State Of Charge):
Konträr zu DOD gibt es SOC, welcher den Ladezustand einer Batterie bezeichnet. Dieser ist dem DOD genau entgegengesetzt. SOC 100 würde bedeuten das ein Batterie voll ist. SOC 30, dass nur noch 30% Restkapazität in der Batterie ist.
durchleitbare Energiemenge und die Kosten pro kWh:
Ein wichtiges Kriterium beim Vergeich von Batterien ist die Frage, was kostet es, eine kWh in der Batterie zu speichern und wieder zu entnehmen. Die Angabe über die Anzahl der Zyklen bei welcher Entladetiefe kann man dem Datenblatt entnehmen (nach dieser Anzahl von Zyklen sollte die Kapazität der Batterie auf etwa 80% der Nennkapazität abgesunken sein). Hierzu gibt es eine einfach Berechnungsweise:
Zyklen * (Entladegrad / 100) * Volt * Amperstunden = durchleitbare Energiemenge in Wh
durchleitbare Energiemenge in Wh / 1.000 = durchleitbare Energiemenge in kWh
2 Beispiele:
Batterie 1: 500 Zyklen DOD 30 12V 120Ah
500 * (30 / 100) * 12V * 120 = 216.000 wh ⇒ 216kWh
Batterie 2: 750 Zyklen DOD 75 12V 80Ah
750 * (75 / 100) * 12V * 80 = 540.000 wh ⇒ 514kWh
Wie man aus der Berechnung erkennt, kann man durch die um 40Ah kleinere Batterie 2 weit mehr als die doppelte Anzahl an kWh hindurchleiten, bis ihre Kapazität auf 80% abgesunken ist.
Der nächste Arbeitsschritt ist jetzt ganz einfach, denn man muss lediglich den Preis für die Batterie durch die durchleitbare Energiemenge teilen. Wenn man es genauer wissen will, dann rechnet man auch noch den zu erwartenden Wirkungsgrad der Batterie mit ein. Dieser sollte bei zyklenfesten Bleibatterien, je nach exaktem Typ und Behandlung der Batterie, zwischen 80% und knapp über 90% liegen.
Auf diese Art kann man für jede Art von Batterie die Kosten für das Speichern ermitteln; in Hinsicht auf die Kosten kann man also Bleibatterien auch direkt mit Litium-Ionen-Speichern vergleichen. Bei Bleibatterien sind diese Aussagen belastbar, denn es stehen weit über 100 Jahre Erfahrung dahinter. Bei LiIon-Speichern handelt es sich bisher nur um (nicht unbegründete) Erwartungen.
Lade/Entladestrom
Der maximal zulassigen Lade/Entladestrom wird immer bezogen auf die Batteriekapazität „C“ angegeben. Eine Ladestromangaben von C/5 bedeutet, dass eine Batterie mit 1/5 der Kapazität in Ampere geladen werden darf.
Beispiel: 100Ah Batterie C/5
100Ah / 5 ⇒ 20A
Dies bedeutet, dass diese 100Ah Batterie mit einem maximalen Ladestrom von 20A geladen werden darf
Umgekehrt gibt es bei speziellen Batterien wie LiFePo auch eine „2C“ Angabe… das bedeutet 2 * C
Beispiel: 100Ah LiFePO4 Batterie 2C
2 * 100Ah ⇒ 200A
Dies bedeutet die Batterie darf maximal mit 200A geladen werden.
Ladezustand und Gefrierpunkt
Die folgende Tabelle gibt die Werte für eine PzS-Batterie. Im Zweifelsfalle gelten immer die Angaben des Herstellers; wenn man die nicht hat, dann gibt die Tabelle zumindest einen Anhaltspunkt (SOC: State of Charge ⇒ Ladezustand; SD: Säuredichte).
PZS
| % SOC | Zellspannung | SD in kg/l | Gefrierpunkt |
|---|---|---|---|
| 100 | 2,13 | 1,29 | - 69 |
| 95 | 2,12 | 1,28 | - 68 |
| 90 | 2,11 | 1,27 | - 63 |
| 80 | 2,09 | 1,25 | - 52 |
| 70 | 2,07 | 1,23 | - 41 |
| 60 | 2,05 | 1,21 | - 31 |
| 50 | 2,03 | 1,19 | - 24 |
| 40 | 2,01 | 1,17 | - 19 |
| 30 | 1,99 | 1,15 | - 15 |
| 20 | 1,97 | 1,13 | - 12 |
| 10 | 1,95 | 1,11 | - 9 |
| 0 | 1,93 | 1,09 | - 7 |
OPZS
| % SOC | SD in kg/l | Gefrierpunkt |
|---|---|---|
| 100 | 1,24 | - 46 |
| 90 | 1,23 | - 41 |
| 80 | 1,22 | - 36 |
| 75 | 1,21 | - 31 |
| 66 | 1,20 | - 28 |
| 58 | 1,19 | - 24 |
| 50 | 1,18 | - 24 |
| 40 | 1,17 | - 19 |
| 30 | 1,16 | - 17 |
| 25 | 1,15 | - 15 |
| 10 | 1,13 | -12 |
| 0 | 1,12 | - 10 |
Bei einer neuwertigen Batterie kann man den Ladezustand sowohl über die Spannung als auch über die Säuredichte bestimmen. Bei einer unbekannten oder schon etwas älteren Batterie muss man beides messen und sich ein Urteil bilden. Hat man etwa eine ältere versinterte Batterie (die aktive Oberfläche der Elektroden ist deutlich kleiner geworden), dann ist die Säuredichte immer höher als es dem tatsächlichen Ladezustand entspricht. Leidet die Batterie an starker Sulfatierung (sehr große Kristalle), dann liegt die Säuredichte immer zu niedrig. Nur über beide Werte gemeinsam kann man den Zustand der Batterie (meist) beurteilen.
Kennt man den Gesundheitszustand (SoH; State of Health) der Batterie relativ gut, dann genügt zur Kontrolle das schnellere Messen der Spannung (wenn möglich aller Zellen) und alle paar Monate sollte man beide Werte messen, um den aktuellen SoH zu bestimmen. Deuten Spannung und Säuredichte auf den gleichen Ladezustand hin, dann ist die Batterie sehr wahrscheinlich fit.